- DIABÈTE
- DIABÈTEConnu dès l’Antiquité égyptienne et gréco-romaine, le diabète doit son nom à la perte urinaire excessive qui le caractérise sur le plan clinique, celle-ci étant accompagnée d’une soif intense, d’où son autre appellation initiale de maladie de la soif. Si ses symptômes furent décrits de façon exhaustive pour la première fois au IIe siècle de notre ère par Aretê de Cappadoce, puis repris et interprétés par Galien, Avicenne, Paracelse et d’autres médecins de l’Antiquité et du Moyen Âge, la teneur sucrée de l’urine ne fut repérée en Occident par Thomas Willis qu’en 1674. L’identification chimique du sucre urinaire fut réalisée en 1838 par Appollinaire Bouchardat et Eugène Melchior Peligot. L’origine pancréatique de la maladie fut révélée en 1889 par Oskar Minkowski et Josef von Mering lorsqu’ils entraînèrent un diabète par pancréatectomie chez le chien. La fonction sécrétoire endocrine des îlots pancréatiques décrits par Paul Langerhans en 1869 fut proposée, en 1893, par Gustave Edouard Laguesse et reprise, en 1898, par Bernhard Naunyn. La découverte de l’insuline fut enfin réalisée en 1921 par Frederick Grant Banting et Charles Herbert Best, bien que déjà annoncée par les travaux légèrement antérieurs de Paulesco. Les résultats successifs issus de recherches effectuées tout au long du XXe siècle ont conduit à définir le diabète sucré en tant que syndrome et non plus en tant que maladie au vu de la diversité de ses aspects cliniques, physiopathologiques et étiologiques.1. Critères biochimiques des troubles diabétiques et classification internationale du diabète sucréLe diabète sucré est défini par une élévation permanente de la glycémie. Les critères biochimiques permettant d’en porter le diagnostic ont été précisés par l’Organisation mondiale de la santé (O.M.S.) en 1980, puis en 1985. Une glycémie à jeun supérieure ou égale à 120 mg/dl lors d’un dosage sur sang veineux total, ou à 140 mg/dl sur plasma veineux affirme le diagnostic de diabète sucré. Si la valeur de la glycémie à jeun est comprise entre 115 et 140 mg/dl (plasma veineux), le diagnostic ne peut être certifié qu’après la pratique d’une épreuve de charge orale en glucose standardisée, appelée épreuve d’hyperglycémie provoquée orale (cf. figure). Si la glycémie égale ou dépasse 200 mg/dl (plasma veineux) deux heures après l’absorption à jeun de 75 grammes de glucose, le diagnostic de diabète sucré est posé. Si la glycémie à la deuxième heure est inférieure à 200 mg/dl mais supérieure ou égale à 140 mg/dl, et si une valeur intermédiaire, à la trentième minute, à la première heure ou à la quatre-vingt-dixième minute du test, dépasse ou égale 200 mg/dl, on parle d’intolérance aux hydrates de carbone, dont le risque est l’évolution vers le diabète sucré.Le diabète gestationnel est suspecté dès que la glycémie à jeun dépasse ou égale 105 mg/dl. Sa confirmation est apportée par la pratique d’une charge orale en glucose de 100 grammes, lorsque deux des quatre critères définis en 1964 par O’Sullivan et Mahan sont présents: glycémie supérieure ou égale à 190 mg/dl à la première heure, 165 mg/dl à la deuxième et 145 mg/dl à la troisième heure, la glycémie à jeun étant supérieure ou égale à 105 mg/dl.Quelle que soit la forme clinique ou la cause du diabète sucré, une insuffisance relative ou absolue de la sécrétion de l’insuline et/ou de son action tissulaire est impliquée. La classification internationale du diabète sucré et des anomalies de la tolérance au glucose se fonde par commodité sur des caractéristiques cliniques. Le diabète sucré est ainsi subdivisé principalement en diabète insulinodépendant, dit de type I, ou non insulinodépendant, dit de type II, selon la nécessité vitale de recours à l’apport d’insuline, présente dans le premier type, absente dans le second. Cette distinction clinique n’est pas sans poser des difficultés nosologiques dans certains cas où s’associent des mécanismes étiopathogéniques et physiopathologiques observés dans les deux grandes formes cliniques. Ces deux aspects du diabète sucré sont les plus fréquemment rencontrés dans les pays développés. Le diabète sucré lié à la malnutrition est, lui, l’apanage des pays asiatiques, africains et de la région caraïbe. Il constitue une entité clinique originale dont on distingue le diabète par pancréatite fibrocalculeuse et le diabète par carence protéique. De nombreuses autres formes du diabète sucré sont réunies dans le cadre des diabètes dits «secondaires», liés à différentes causes: maladies pancréatiques (pancréatite chronique, cancer du pancréas, hémochromatose, etc.), endocrinopathies par excès de sécrétion d’hormones hyperglycémiantes (syndromes de Cushing, acromégalie, glucagonomes, phéochromocytomes, etc.), diabètes iatrogènes ou toxiques, syndromes génétiques affectant le métabolisme du glucose, anomalies du récepteur à insuline, etc.2. Causes et mécanismesLe diabète sucré insulinodépendant, de type IAtteignant dans la plupart des cas l’enfant et l’adulte jeune, le diabète sucré de type I est de plus en plus clairement lié au développement d’une auto-immunité responsable de la destruction des cellules B ou bêta, insulinosécrétrices, des îlots de Langerhans pancréatiques. Il représente environ 10 p. 100 des cas de diabète sucré dans les pays occidentaux et prédomine dans les populations d’origine nord européenne. La mise en évidence d’une réaction inflammatoire avec infiltration de globules blancs (lymphocytes et macrophages principalement) au sein des îlots de Langerhans, appelée «insulite», lors d’autopsies de sujets atteints ou dans des modèles animaux (rats BB, souris NOD), est le fondement de l’origine auto-immunitaire attribuée au diabète de type I. La présence d’anticorps plasmatiques dirigés contre les cellules d’îlots et contre l’insuline fréquemment rencontrés (80 p. 100 des cas) renforce cette hypothèse maintenant généralement admise. L’obtention inconstante de rémissions transitoires de la maladie grâce à des traitements immunomodulateurs (ciclosporine) l’argumente également de façon indirecte. Enfin, l’association dans certains cas du diabète de type I à d’autres maladies à consonance auto-immune (thyroïdite de Hashimoto, maladie de Basedow, rétraction corticale surrénalienne, anémie de Biermer, myasthénie, maladie caeliaque, etc.) suggère la participation d’une réaction auto-immune plus ou moins disséminée.La concordance de 30 à 50 p. 100 pour le diabète de type I chez les jumeaux vrais monozygotes et la prévalence accrue de la maladie dans la fratrie et chez les ascendants directs au premier degré traduisent l’implication vraisemblable de facteurs génétiques sur le plan étiopathogénique. L’étude des antigènes leucocytaires humains (système HLA) chez les sujets occidentaux atteints de la maladie a montré un lien préférentiel avec les antigènes de classe II: DR3 et DR4, et à un moindre degré avec les antigènes de classe I: B8, B15, B18, A1, C3. Des travaux récents rapportent la prévalence très forte (supérieure à 90 p. 100) de la présence d’un acide aminé différent d’un aspartate en cinquante-septième position sur la chaîne bêta de l’antigène HLA DQ chez les diabétiques de type I.Le rôle de facteurs d’environnement dans la pathogenèse du diabète de type I a été suggéré depuis longtemps. Ces agents peuvent soit détruire directement les cellules bêta, soit favoriser le développement d’une réaction auto-immunitaire, soit révéler un déficit antérieurement présent de l’insulinosécrétion par une résistance induite à l’action de l’insuline, soit accroître la sensibilité des cellules bêta à d’autres agresseurs. Les cas où la responsabilité directe de facteurs environnementaux dans l’induction du diabète insulinodépendant a été documentée restent néanmoins peu nombreux. Des agents chimiques tels que l’alloxane, la streptozotocine, la pentamidine ou certains raticides sont connus comme bêta cytotoxiques chez l’animal. Certains composants alimentaires tels que les acides gras ou les protéines animales modifient le risque diabétique chez le rat BB ou la souris NOD spontanément prédisposés à la maladie. Enfin, le rôle d’agresseurs viraux a été plus largement documenté chez l’homme: virus des oreillons, virus coxsackies B4, cytomégalovirus, virus de la rubéole, à partir d’observations épidémiologiques ou, plus rarement, de cas cliniques isolés (rubéole congénitale, infections à coxsackies B4). Là aussi, l’intervention d’un terrain génétique à risque a été impliquée dans le déterminisme des conséquences diabétogènes de l’infection virale (présence de l’antigène HLA B8 ou DR3 pour le risque lié à la rubéole congénitale).Enfin, il semble que des facteurs métaboliques, au premier rang desquels l’hyperglycémie elle-même, puissent participer à l’épuisement des cellules insulinosécrétrices par leur stimulation excessive directe et indirecte (résistance à l’action périphérique de l’insuline) à la phase de révélation clinique du diabète I. Leur correction et l’apport d’insuline exogène paraissent capables de restaurer en partie l’activité fonctionnelle des cellules bêta et de réduire leur antigénicité dans la réaction auto-immune. L’induction de rémissions de l’insulinodépendance par une correction métabolique optimale, grâce à l’apport d’insuline, et parfois spontanément, à la phase précoce de l’émergence clinique de la maladie est un reflet de ce concept récent de la glucotoxicité.Le diabète sucré non insulinodépendant, de type IICette forme clinique du diabète sucré est de loin la plus fréquente dans les pays développés (plus de 80 p. 100 des cas). Si les processus physiopathologiques impliqués dans la maladie sont de mieux en mieux connus, ses causes initiales restent mal définies. Trois grands mécanismes participent à l’hyperglycémie: une sécrétion inadéquate d’insuline en valeur absolue ou relative aux besoins, une résistance des tissus musculaires et adipeux à l’action de l’insuline, une absence de suppression de la production hépatique de glucose par l’insuline et une stimulation excessive de cette production par le glucagon. Ces processus physiopathologiques sont interdépendants à la phase clinique de la maladie et s’aggravent mutuellement les uns les autres, sans que l’on sache si l’un d’entre eux est initialement prédominant sur le plan étiologique.L’insuffisance de l’insulinosécrétion est repérable dès le début de la maladie lors de la stimulation des cellules bêta par l’apport oral ou intraveineux de glucose. L’insulinémie à jeun est alors voisine de celle des sujets non diabétiques, voire supérieure, mais son ascension lors de la majoration provoquée de la glycémie est inadéquate et insuffisante en regard des besoins accrus par l’insulinorésistance périphérique. Une baisse de la sensibilité des cellules bêta au stimulus glucosé semble expliquer l’érosion de la phase précoce de l’insulinosécrétion. Outre une réceptivité réduite au glucose, un défaut de coopération entre les cellules bêta et une altération fonctionnelle des cellules bêta sont invoqués. Morphologiquement, la réduction de taille des îlots de Langerhans, la baisse de la masse totale des cellules bêta, les modifications des cellules bêta avec présence de dépôts amyloïdes (amyline) et la fibrose péri-insulaire rendent compte du déficit fonctionnel. La progression de la maladie voit se constituer un défaut de l’insulinémie basale et une érosion de la deuxième phase de l’insulinosécrétion après stimulation glucosée. Parallèlement au déficit de l’insulinosécrétion, une libération excessive de glucagon par les cellules alpha des îlots de Langerhans est observée. Les mécanismes en cause restent mal éclaircis.Le défaut de l’insulinosécrétion et l’excès de libération de glucagon contribuent largement à la production excessive de glucose par le foie. Un défaut de suppression par le glucose lui-même de sa production hépatique paraît également intervenir. L’élévation de la glycémie du jeûne est étroitement liée au début de la maladie à la production hépatique de glucose.La résistance tissulaire à l’insuline est une entité essentielle dans la physiopathologie du diabète de type II. Le défaut de la sensibilité à l’insuline – qui est mesurable – fait intervenir une réduction du nombre des récepteurs à l’insuline et surtout une altération des mécanismes cellulaires en aval du récepteur. Une réduction du nombre des transporteurs membranaires permettant l’entrée cellulaire du glucose et dépendants de l’insuline a pu être constatée. Il en résulte une diminution de la métabolisation du glucose par le muscle, le foie et le tissu adipeux dont les capacités de clairance du glucose plasmatique sont réduites. Les voies du métabolisme oxydatif et surtout non oxydatif du glucose (synthèse de glycogène) sont diminuées. L’insulinodépendance de l’activité glycogène-synthase explique en partie le rôle du défaut de l’insulinosécrétion dans la majoration de la résistance à l’insuline. L’hyperglycémie en elle-même paraît altérer également la réceptivité à l’insuline. Le rôle de l’amyline, anormalement présente dans les cellules bêta, a été récemment envisagé dans la dégradation de la sensibilité à l’insuline. L’insulinorésistance ne fait qu’aggraver la carence relative de la sécrétion d’insuline en accroissant les besoins insuliniques, entretenant ainsi un véritable cercle vicieux.Le diabète sucré de type II est souvent associé à l’excès de poids. La surcharge en masse grasse de l’organisme majore la résistance à l’action de l’insuline et favorise ainsi l’éclosion du diabète sucré. Une diminution du nombre des récepteurs à l’insuline et une altération des mécanismes intracellulaires situés au-delà des récepteurs ont pu être objectivées dans l’obésité. Le surpoids apparaît cependant plus comme un facteur précipitant la révélation du diabète qu’un facteur étiologique direct. Le risque d’apparition du diabète chez l’obèse semble ainsi être déterminé par une prédisposition indépendante propre, comme l’illustrent les cas inverses d’obésité considérable sans anomalies de la tolérance glucosée. Le rôle de l’excès pondéral est cependant net sur le plan épidémiologique, comme l’a montré, depuis 1940, l’exemple des Indiens d’Amérique, en extériorisant au niveau des populations un risque sous-jacent de diabète, qui aurait pu être méconnu ou se manifester plus tardivement en l’absence d’excès de poids.Le caractère familial du diabète sucré de type II a été reconnu depuis longtemps. L’épidémiologie actuelle démontre la présence d’une concordance chez les jumeaux vrais (monozygotes) de l’ordre de 80 p. 100 et chez les faux jumeaux (dizygotes) de 40 p. 100. Les investigations à la recherche d’un gène majeur de transmission de l’affection restent infructueuses jusqu’à présent. Plusieurs régions du génome ont été cependant incriminées en tant que gènes de prédisposition: gène de l’insuline, gène du récepteur à l’insuline, gène de plusieurs apolipoprotéines. Seule la forme clinique particulière du diabète non insulinodépendant du sujet jeune (dit M.O.D.Y. – maturity onset diabetes of the young , en anglais) a été récemment rattachée à une transmission autosomique dominante par mutation au niveau du bras court du chromosome 7.La transmission plus importante de la maladie lorsque la mère est atteinte, observée chez les Indiens Pimas du Nouveau-Mexique, laisse penser que l’ambiance glycémique à laquelle est exposé le fœtus joue aussi un rôle favorisant à l’égard du risque de diabète de type II.Le rôle de l’excès d’apports glucidiques, notamment sous forme de sucres simples dans la ration alimentaire, dans l’exposition au risque de diabète de type II n’est pas reconnu actuellement en l’absence d’un terrain de prédisposition.Enfin, l’association préférentielle, établie récemment à partir d’études épidémiologiques, entre le diabète de type II, l’hypertension artérielle essentielle, l’obésité de répartition androïde et l’hypertriglycéridémie laisse envisager un lien génétique de prédisposition, commun à ces différentes entités réunies dans l’appellation de «syndrome X» proposée par G. Reaven.3. Signes cliniquesSi certains aspects cliniques sont communs aux deux formes principales insulinodépendante et non insulinodépendante du diabète sucré, leur mode classique de révélation est généralement différent.Diabète insulinodépendant, de type ILe diabète de type I se révèle le plus souvent sur un mode aigu, et affecte surtout l’enfant et l’adulte de moins de quarante ans. Le syndrome cardinal typique comprend l’apparition d’une polyurie diurne et nocturne associée à une soif intense (polydipsie), chiffrée à plusieurs litres par vingt-quatre heures. Une polyphagie avec un attrait pour les sucres est souvent notée. Paradoxalement, un amaigrissement rapide et massif de plusieurs kilogrammes est observé. Une fatigue plus ou moins prononcée ne tarde pas à apparaître. Parfois, des infections cutanéo-muqueuses surviennent: folliculite ou furonculose, vulvo-vaginite ou balano-posthite selon le sexe. La négligence de ces symptômes conduit à une situation de déshydratation globale et à une polypnée, témoins d’une décompensation céto-acidosique. L’haleine douceâtre, «de pomme reinette», extériorise l’accumulation dans l’organisme des corps cétoniques, déchets métaboliques issus de la mise en jeu de la néoglucogenèse. La cétogenèse marque la carence absolue en insuline, empêchant la pénétration intracellulaire du glucose, d’où sa synthèse de novo à partir du catabolisme des acides gras.Sur le plan biologique, le diagnostic est porté par la présence abondante de glucose et la mise en évidence de corps cétoniques dans les urines, associées à l’élévation franche de la glycémie. Ces éléments sont repérés au cabinet de consultation au moyen de bandelettes réactives urinaires et d’une mesure glycémique du sang capillaire, par lecture visuelle (indicateur coloré) ou au moyen d’un appareil de réflectométrie. La situation décrite est une urgence métabolique qui doit conduire à l’apport d’insuline. Tout retard expose au coma céto-acidosique. Celui-ci résulte d’une souffrance de l’organisme liée au développement d’une acidose métabolique par accumulation des corps cétoniques, marquée par une baisse du pH sanguin et des bicarbonates plasmatiques. La tentative de compensation respiratoire est caractérisée par une hypocapnie (baisse du CO2 dans le sang). La déshydratation sévère induite par la polyurie, entraînée elle-même par la glycosurie, favorise la rétention des corps cétoniques et l’aggravation de l’acidose par réduction de la perfusion sanguine rénale. L’évolution spontanée est mortelle.La révélation aiguë cétosique du diabète de type I peut être favorisée par une infection de rencontre, notamment des voies aériennes, ou tout épisode de stress (accident traumatique, intervention chirurgicale, etc.) qui augmente les besoins insuliniques et démasque ainsi l’effondrement des capacités d’insulinosécrétion.Diabète non insulinodépendant, de type IIL’installation du diabète de type II est généralement insidieuse. Sa découverte est de nos jours souvent fortuite à l’occasion d’une recherche systématique de glycosurie ou d’un dosage glycémique prescrit pour une symptomatologie atypique (fatigue, sensation de malaise, etc). Parfois, des signes cliniques suggestifs justifient le contrôle de la glycémie: soif inhabituelle avec tendance polyurique, perte de poids inexpliquée, infections cutanées ou muqueuses récidivantes, parodontopathie, retard de cicatrisation d’une plaie minime. La découverte très tardive peut survenir lors d’une complication neurologique, cardiovasculaire ou rétinienne. L’affection touche habituellement les sujets d’âge mûr, volontiers en surpoids. Sa recherche systématique est justifiée chez les sujets obèses, hypertendus, hyperlipidémiques ou atteints de pathologie cardiovasculaire. Son ancienneté est toujours méconnue en raison de son début progressif, justifiant d’emblée la recherche de complications chroniques liées au diabète. Le diagnostic est affirmé par l’élévation de la glycémie à jeun selon les critères de l’O.M.S., ou lors de la pratique d’une épreuve de H.G.P.O. montrant une glycémie dépassant 200 mg/dl à la deuxième heure. La glycosurie n’a qu’une médiocre valeur de dépistage devant la possibilité d’erreur par excès (diabète rénal par abaissement des capacités de réabsorption tubulaire du glucose) ou par défaut (élévation du seuil d’apparition de la glycosurie chez le sujet âgé ou dont la fonction rénale est altérée). L’utilisation de comprimés-tests urinaires non spécifiques du glucose (Clinitest) peut faire croire à tort au diabète par la détection de sucres réducteurs différents du glucose (melliturie). La diffusion actuelle des méthodes de dépistage lors de visites de médecine du travail ou de bilans de santé systématiques amène à poser le diagnostic de plus en plus précocement dans les pays développés économiquement. La recherche de glycosurie est obligatoire pendant la grossesse.4. ComplicationsLes conséquences de l’hyperglycémie chronique liée au diabète insuffisamment traité ou méconnu en font sa gravité à plus ou moins long terme.Des complications aiguës métaboliques sans hyperglycémie peuvent également le menacer à court terme. Elles surviennent habituellement chez les sujets négligeant leur traitement ou insuffisamment suivis, ou à l’occasion d’épisodes intercurrents. La plus fréquente des complications aiguës est l’hypoglycémie d’origine iatrogène chez les sujets traités par insuline ou sulfamides hypoglycémiants. Elle se marque sur le plan clinique, dans un premier temps, par des signes adrénergiques en rapport avec la mise en jeu des systèmes hyperglycémiants de contre-régulation (glucagon, adrénaline, cortisol, hormone de croissance). Les signes cliniques apparaissent le plus souvent lorsque la glycémie est inférieure à 80 mg/dl et comprennent: sueurs, tremblements, sensation de fringale, palpitations, pâleur, impression ébrieuse. La perception de ces signes devient plus difficile avec l’ancienneté du diabète, d’autant plus que la glycémie est souvent trop basse et que les épisodes hypoglycémiques sont fréquents. La présence d’une neuropathie autonome compliquant le diabète sucré en est un facteur prédisposant.Les manifestations neurologiques sont polymorphes – confusion mentale, convulsions, épisode d’amaurose ou de paralysie, comportement psychiatrique avec conduites étranges ou délire –, et vont jusqu’au coma. L’apport de glucose oral ou intraveineux selon l’état de conscience corrige rapidement les signes sans séquelles à condition d’agir au plus tôt. Les épisodes d’hypoglycémie sont souvent déclenchés par des erreurs diététiques (ration glucidique insuffisante), un excès d’apport d’insuline ou de sulfamides, une activité physique excessive non prévenue. Toute perte de connaissance brutale chez le diabétique doit faire évoquer ce diagnostic et conduire à l’apport de sucre par voie veineuse et/ou de glucagon parentéral.La décompensation céto-acidosique survient chez le diabétique insulinodépendant dont les besoins insuliniques sont insuffisamment couverts (cf. supra ). De nos jours, elle est généralement la conséquence d’un défaut de surveillance et d’adaptation des doses d’insuline. Elle se constitue assez souvent lors d’épisodes intercurrents infectieux ou traumatisants. La recherche systématique des corps cétoniques dans les urines lorsque la glycémie dépasse 200 mg/dl, et au mieux une fois par jour quelle que soit la glycémie, en est la meilleure prévention.Le coma hyperosmolaire est beaucoup plus rare et atteint le diabétique non insulinodépendant âgé et débilité en général. Cette détresse métabolique résulte d’une insuffisance de compensation hydrique (adipsie) lors d’un épisode fébrile ou de pertes digestives (diarrhée, vomissements), ou lors d’une exposition à la chaleur climatique, chez un diabétique mal équilibré. Elle se marque sur le plan symptomatique par une déshydratation globale sévère qui conduit à des troubles neuropsychiques et à une hypotension artérielle. L’osmolarité plasmatique est élevée, avec hyperglycémie, hypernatrémie, rétention azotée, associée à une hémoconcentration (hématocrite et protidémie élevés). Son pronostic est souvent mauvais par les complications neurologiques, cardiovasculaires et infectieuses qui l’accompagnent rapidement sur ce terrain altéré. L’apport de solutés hypotoniques et d’insuline est nécessaire pour corriger l’hyperosmolarité.Si les complications aiguës métaboliques se raréfient grâce au meilleur encadrement et à l’éducation à l’autosurveillance des diabétiques, les complications chroniques demeurent le lourd tribut du diabète sucré au long cours. La normalisation insuffisante et inconstante de la glycémie par le traitement en constitue la cause principale par différents mécanismes: glycosylation des protéines tissulaires de l’organisme, anomalies de l’hémostase et de l’endothélium vasculaire, accumulation de fructose et de sorbitol par l’activité aldose-réductase, désordres du métabolisme du myo-inositol dans les fibres nerveuses, hyperlipidémie. Les facteurs de risque cardiovasculaire associés ne font qu’en augmenter la prévalence: tabagisme, hypertension artérielle, hypercholestérolémie, obésité, sédentarité. Le caractère quasi asymptomatique de l’hyperglycémie modérée au long cours favorise sa négligence et expose largement à la survenue des complications. Le traitement du diabète, même bien conduit, ne permet en outre chez de nombreux patients qu’un équilibre imparfait.L’altération des petits vaisseaux, ou microangiopathie, est une complication caractéristique du diabète. Ses manifestations sont les plus redoutables au niveau rétinien et glomérulaire. La rétinopathie diabétique apparaît généralement après au moins cinq ans d’évolution du diabète de type I, mais peut être présente d’emblée à la découverte du diabète de type II. Elle se marque initialement par des lésions mineures: microanévrismes, microhémorragies, exsudats secs, généralement sans conséquence fonctionnelle. Les premiers signes de gravité comprennent la constitution de zones d’ischémie rétinienne par occlusion des capillaires rétiniens et/ou d’exsudats étendus menant à l’œdème rétinien. L’atteinte de la macula, zone responsable de la vision centrale précise, amène les premières altérations de l’acuité visuelle. Le développement d’une néovascularisation proliférante en réponse à l’ischémie rétinienne entraîne les conséquences les plus graves pour la vision par des décollements de la rétine, des hémorragies du vitré, qui peuvent mener à la cécité. La pratique régulière de l’examen du fond de l’œil à l’ophtalmoscope et de l’angiographie rétinienne à la fluorescéine permet d’en repérer les premières manifestations justiciables d’un traitement préventif des complications les plus graves (photocoagulation au laser, amélioration du contrôle glycémique). La glomérulosclérose diabétique constitue la lésion rénale la plus spécifique du diabète. Elle est détectée précocement de nos jours par le dosage régulier de la microalbuminurie. Lorsque celle-ci dépasse 20 猪g/mn mais n’est pas détectable par les bandelettes urinaires (Albustix), une réversibilité est possible par une amélioration glycémique, le contrôle strict de la tension artérielle et/ou la limitation des apports protéiques alimentaires. L’apparition d’une protéinurie «clinique», repérée par l’Albustix, traduit la présence de lésions glomérulaires irréversibles. Seul le contrôle parfait de la tension artérielle peut ralentir l’évolution vers l’installation d’un syndrome néphrotique (protéinurie supérieure à 3 g par jour) et d’une insuffisance rénale de plus en plus grave jusqu’à la nécessité de la dialyse ou de la greffe de rein. Les infections urinaires plus fréquentes chez le diabétique, l’hypertension artérielle, la sensibilité accrue aux produits de contraste radiologiques et aux substances néphrotoxiques (aminosides, anti-inflammatoires non stéroïdiens, etc.), la survenue de nécroses papillaires aggravent le pronostic rénal du diabétique.L’atteinte des branches distales des artères des membres inférieurs, des artères coronaires, des artères à destinée cérébrale s’ajoute à l’athérosclérose accélérée des artères de gros et moyen calibres chez le diabétique. Il en résulte une prévalence accrue de l’artérite des membres inférieurs dans sa forme la plus grave de gangrène ischémique conduisant à l’amputation, de l’insuffisance coronaire et cardiaque et des accidents vasculaires cérébraux (ramollissements). Le risque vasculaire est particulièrement élevé pour le diabétique non insulinodépendant et/ou en présence d’une atteinte rénale par le cumul des facteurs athérogènes.La dégradation des nerfs périphériques constitue une complication quasi obligatoire du diabète sucré. La polynévrite diabétique en est la forme clinique principale. Elle conduit à une perte de la sensibilité des extrémités des membres inférieurs, avec disparition des réflexes ostéotendineux aisément repérable par l’examen clinique. Les troubles trophiques qui résultent de la dénervation joints à l’absence de perception des traumatismes du pied exposent à de graves complications: déformation de l’architecture osseuse du pied (pied cubique de Charcot), maux perforants plantaires par ulcération des zones d’appui, sièges de complications infectieuses profondes et extensives (ostéite). La polynévrite peut être à l’origine de symptômes désagréables et invalidants: crampes, dysesthésies (fourmillements), paresthésies (douleurs), causalgies (brûlures). L’atteinte mononévritique peut affecter le diabétique à tout moment de la maladie. Douloureuse, parfois paralytique, elle peut siéger au niveau du nerf crural, du nerf sciatique poplité externe, du nerf fémoro-cutané (méralgie paresthésique), du nerf facial ou de nerfs oculo-moteurs. L’amélioration glycémique en est le traitement principal. Les complications neurologiques touchent également les nerfs et plexus nerveux à destinée viscérale (neuropathie autonome), se manifestant par une hypotension orthostatique, une tachycardie permanente, une rétention chronique d’urine, des troubles du transit digestif, une perte du réflexe photomoteur, une non-perception des signes adrénergiques de l’hypoglycémie, une impuissance ou une frigidité.Pratiquement tous les tissus et organes peuvent être affectés à plus ou moins long terme par le diabète, et on citera pour leur fréquence: la cataracte, la maladie de Dupuytren, les syndromes de compression nerveuse canalaire, les lésions para-articulaires de la main, de l’épaule, du pied, la nécrobiose lipoïdique de la peau, la parodontose avec chute spontanée des dents, les troubles du cycle menstruel et le retard pubertaire, les infections cutanéo-muqueuses surtout à staphylocoques dorés et à gandida.Les complications de la grossesse de la femme diabétique sont particulièrement redoutées. La qualité de l’équilibre glycémique avant même la conception s’impose pour les réduire. Le risque malformatif fœtal est accru chez la femme diabétique d’autant plus que les premières semaines de grossesse se déroulent en hyperglycémie. La macrosomie fœtale (hypertrophie) constitue le deuxième risque majeur de la grossesse. Elle survient surtout lorsque l’équilibre est insuffisant au troisième trimestre de grossesse, induisant un hyperinsulinisme fœtal responsable du développement pondéral excessif. Par contraste, la maturation fœtale de fin de grossesse est souvent retardée dans ce contexte, d’où un risque de souffrance prénatale et néonatale accru. Outre les problèmes obstétricaux lors de l’accouchement dus à l’hypertrophie fœtale, qui conduisent souvent à la césarienne, la survenue néonatale d’hypoglycémies doit être prévenue. La présence chez la mère de complications microangiopathiques rétinienne ou rénales augmente le risque toxémique (hypertension artérielle) et expose à une évolutivité accrue de ces altérations, durant la grossesse, conduisant parfois à proposer l’avortement thérapeutique.5. Traitement et mesures préventivesLe régime restreint en hydrates de carbone (sucres, féculents, etc.) demeure la base de la thérapeutique du diabète. Les sucres simples, dits «d’absorption rapide», contenus dans les pâtisseries, les confiseries, les sirops, les jus de fruits sucrés, les crèmes glacées, ont un effet hyperglycémiant important et doivent être éliminés de la ration alimentaire. Seuls les diabétiques insulinodépendants bien équilibrés peuvent occasionnellement en consommer à la fin d’un repas complet, en quantité modérée. Les aliments contenant des sucres complexes, dits «d’absorption lente», moins hyperglycémiants, tels que le pain, les biscottes, les pâtes alimentaires, les féculents, les pommes de terre, le riz, doivent être consommés de manière limitée et répartis de façon adaptée sur la journée. Leur quantité est réduite en fonction de l’excès de poids. Leur prise est divisée entre les trois repas principaux et, pour les diabétiques traités par l’insuline, lors des collations jugées utiles au milieu de la matinée, au milieu de l’après-midi et parfois au coucher pour éviter les hypoglycémies. Les fruits sont conseillés à la fin des repas principaux ou lors des collations, en évitant ceux qui sont trop riches en sucre (bananes, raisin). Comme pour le sujet non diabétique, les graisses alimentaires ne doivent pas excéder 35 p. 100 des apports caloriques, et les graisses d’origine animale (beurre, crème fraîche, charcuterie, etc.) sont réduites à un tiers des apports en raison de leur effet néfaste pour le risque cardiovasculaire. Les apports protidiques (viande, poisson, produits laitiers, œufs) sont libres, mais l’apparition de signes d’altération rénale même mineure (microalbuminurie) conduit à les limiter. La bonne observance du régime est un élément essentiel de traitement, surtout pour les diabétiques en surpoids non insulinodépendants où il peut suffire à équilibrer la glycémie.Les médicaments antidiabétiques pris par voie orale sont prescrits dès lors que le diabétique non insulinodépendant reste hyperglycémique malgré une diététique bien suivie. Deux grandes classes de produits sont utilisées: les biguanides et les sulfamides hypoglycémiants. La metformine est le seul biguanide actuellement commercialisé. Ses effets comprennent une réduction de l’absorption intestinale des hydrates de carbone, une diminution de la production hépatique de glucose et une amélioration de la sensibilité tissulaire à l’insuline. Son indication principale est le diabète des sujets en excès de poids. Les sulfamides hypoglycémiants stimulent la sécrétion d’insuline par les cellules B des îlots de Langerhans. Sulfamides et biguanides peuvent être associés et exercent une action antidiabétique complémentaire.L’insuline est le seul traitement utilisable pour les diabétiques insulinodépendants et peut s’avérer nécessaire pour les sujets initialement non insulinodépendants non équilibrés par le régime et les antidiabétiques oraux. C’est le seul traitement utilisable durant la grossesse lorsque le régime restreint en hydrates de carbone est insuffisant. L’insuline ne peut être administrée que par voie parentérale, car les sucs digestifs la détruisent, rendant la voie orale impossible. Les injections d’insuline se font le plus souvent sous la peau, les voies intraveineuse, intramusculaire ou intrapéritonéale relevant d’indications particulières. L’adjonction de zinc ou de protamine à l’insuline permet d’en ralentir la résorption sous-cutanée et donc d’en prolonger l’effet hypoglycémiant. Ce type d’insulines ainsi modifiées, dites d’action intermédiaire ou lente, nécessite une ou deux injections par jour pour couvrir les vingt-quatre heures. L’insuline ordinaire, dite d’action rapide, n’agit que de six à huit heures. Son effet hypoglycémiant est plus incisif. Son utilisation peut être couplée à celle d’insulines d’action intermédiaire ou lente. Pour injecter l’insuline, on emploie soit des seringues, soit des «stylos» injecteurs, soit des pompes miniaturisées portables, voire implantables.L’évaluation de l’efficacité du traitement et le calcul de la dose d’insuline à pratiquer, le cas échéant, nécessitent la réalisation d’une surveillance à laquelle doivent être éduqués les patients. Elle peut se limiter à un ou plusieurs contrôles de la glycémie au laboratoire par mois pour les diabètes non insulinodépendants stables. Les diabétiques traités par insuline, et parfois ceux qui sont traités par médicaments oraux mais instables, doivent pratiquer une surveillance rapprochée une ou plusieurs fois par jour, réalisée au mieux par eux-mêmes. Longtemps limitée à la recherche de sucre et d’acétone dans les urines, cette surveillance est de nos jours effectuée avec plus d’exactitude sur la glycémie capillaire. Le sang recueilli par piqûre d’un doigt est déposé sur une bandelette réactive dont la coloration indique le niveau de la glycémie. La fréquence des contrôles dépend de l’instabilité du diabète et du nombre d’injections d’insuline. La surveillance du diabète est complétée par la pratique du dosage sanguin de l’hémoglobine glycosylée au laboratoire. Sa valeur indique la qualité globale de l’équilibre du diabète durant une période de deux mois environ.Une des complications les plus fréquentes du traitement par l’insuline ou les sulfamides hypoglycémiants est la survenue d’hypoglycémies. Le diabétique doit apprendre à en reconnaître les premiers signes (cf. supra ) pour les corriger au moyen d’une prise immédiate de sucre et éviter leur récidive.Le traitement du diabète est en progrès constant. Les greffes de pancréas et l’implantation de pompes à insuline sont en cours de développement; les greffes d’îlots de Langerhans et les pancréas artificiels ou bio-artificiels implantables sont des voies thérapeutiques d’avenir.Le fléau individuel et social que représente le diabète sous toutes ses formes conduit à en développer le dépistage précoce et à envisager sa prévention et/ou son traitement à un stade pré-clinique. Les travaux de recherche sur les marqueurs du risque de diabète et les indices de diabète à un stade pré-clinique doivent permettre à terme de repérer les sujets menacés pour mettre en place des traitements préventifs de la survenue de la maladie. Les grands organismes internationaux de santé publique (O.M.S.), les instituts de recherche médicale, les associations nationales et internationales réunissant les malades diabétiques et les personnels qui les prennent en charge jouent un rôle essentiel dans la lutte contre ce fléau.
diabète [ djabɛt ] n. m.• dizabete XVe; lat. médiév. diabetes, gr. diabêtês « qui traverse », à cause de l'émission surabondante d'urine1 ♦ Méd. État pathologique s'accompagnant d'une élimination excessive d'urine, avec soif intense. Diabète insipide, en rapport avec une perturbation hormonale de l'hypophyse. Diabète sucré (cf. infra 2o). Diabète gras, maigre. Diabète bronzé. ⇒ hémochromatose.2 ♦ Cour. Maladie liée à un trouble de l'assimilation des glucides, avec présence de sucre dans le sang (hyperglycémie) et dans les urines (glycosurie). Traitement du diabète par l'insuline.
● diabète nom masculin (bas latin diabetes, du grec diabêtês ; de diabainein, passer à travers) Toute maladie caractérisée par l'élimination excessive d'une substance dans les urines. ● diabète (expressions) nom masculin (bas latin diabetes, du grec diabêtês ; de diabainein, passer à travers) Diabète bronzé, synonyme de hémochromatose. Diabète gestationnel, diabète sucré transitoire survenant pendant la grossesse. Diabète insipide, trouble fonctionnel caractérisé par une incapacité des reins à concentrer les urines, se traduisant par une polyurie (émission d'une quantité d'urines très importante et diluée) et par une polydipsie (soif intense). Diabète rénal, présence excessive de sucre dans les urines alors que le taux de glucose dans le sang est normal. Diabète sucré, affection chronique caractérisée par une glycosurie (présence de sucre dans les urines) provenant d'une hyperglycémie (excès de sucre dans le sang).diabèten. m. Terme générique désignant un ensemble de situations médicales dans lesquelles des substances utiles (ex. le glucose) restent inutilisées, s'accumulent dans le sang (ex. hyperglycémie), puis traversent les systèmes sanguin et rénal pour passer dans les urines (ex. glycosurie). (Le mot employé sans épithète désigne généralement le diabète sucré.)Encycl. Le diabète sucré est caractérisé par une augmentation de la glycémie avec présence de sucre dans les urines. Il peut se compliquer par un coma diabétique nécessitant un traitement d'urgence par l'insuline et la réhydratation. Le diabète sucré peut être dû à une sécrétion insuffisante d'insuline par le pancréas (diabète dit insulino-dépendant, car le sujet doit recevoir un apport quotidien d'insuline) ou à un trouble de l'utilisation du glucose sans défaut d'insuline. Le diabète insipide, dû à l'absence de sécrétion d'A.D.H. (hormone antidiurétique) par l'hypophyse, se manifeste par une diurèse très importante et immuable, quels que soient les apports hydriques. Il est maintenant traité avec succès par l'administration d'A.D.H.⇒DIABÈTE, subst. masc.MÉD. Maladie caractérisée par une abondante élimination urinaire, accompagnée d'une augmentation de la faim et de la soif. Avoir du diabète, soigner son diabète; diabète insipide.— En partic., usuel. Diabète (sucré). ,,Maladie caractérisée par une élévation du taux de glucose dans le sang, et par sa présence dans les urines`` (Méd. Psychanal. 1971). Ma bouteille, je vais pisser dans mes culottes! Il se croit le diabète et tâte sans cesse le pouls à son urine. (GONCOURT, Journal, 1863, p. 537). Il ne suffit pas (...) de faire disparaître les symptômes du diabète en donnant de l'insuline au malade. L'insuline ne guérit pas le diabète (CARREL, L'Homme, 1935, p. 382).Rem. On rencontre ds la docum. a) Diabétogène, adj. Qui provoque le diabète. Une hormone diabétogène (BARIÉTY, COURY, Hist. méd., 1963, p. 762). b) Diabétologie, subst. fém. Partie de la médecine traitant du diabète. 1830, époque à laquelle Bouchardat établit les fondements de la diabétologie (ID., ibid., p. 761). c) Diabétologue, subst. masc. Médecin spécialiste du traitement du diabète. De nouvelles techniques de dosage ont été mises au point par les diabétologues américains (ID., ibid., p. 639).Prononc. et Orth. :[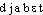 ]. Enq. :/djabet/. Ac. 1762 : diabètes, Ac. 1798 : diabétès; ensuite : diabète. Étymol. et Hist. 1520 diabete (Le Guidon en français ap. SIGURS, p. 393). Empr. au b. lat. diabetes « diabète », lui-même empr. au gr.
]. Enq. :/djabet/. Ac. 1762 : diabètes, Ac. 1798 : diabétès; ensuite : diabète. Étymol. et Hist. 1520 diabete (Le Guidon en français ap. SIGURS, p. 393). Empr. au b. lat. diabetes « diabète », lui-même empr. au gr. 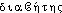 « id. » proprement « qui traverse », dér. de
« id. » proprement « qui traverse », dér. de 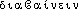 « passer à travers »; cf. lat. impérial diabetes « conduit, canal par où l'eau passe ». Fréq. abs. littér. :45. Bbg. EYRAUD (D.). Vive la lang. Vie Lang. 1969, p. 199.diabète [djabɛt] n. m.ÉTYM. XVe, dizabete; lat. médiéval diabetes, grec diabêtês « qui traverse », à cause de l'émission surabondante d'urine.❖♦ Médecine.1 État pathologique s'accompagnant d'une élimination excessive d'urine, avec soif intense. || Diabète insipide, en rapport avec une perturbation hormonale de l'hypophyse.2 Diabète sucré, (cour.) diabète : maladie liée à un trouble de l'assimilation des glucides, avec présence de sucre dans le sang (hyperglycémie) et dans les urines (glycosurie). || Avoir du diabète. ⇒ Diabétique (cit.). || Traitement du diabète par l'insuline.0 (…) une main enflée par le diabète, mais qui serre tout de suite sans tâtonner, dure, impérieuse.Bernanos, Journal d'un curé de campagne, I, p. 21.➪ tableau Principales maladies et affections.❖DÉR. Diabétique, diabétogène, diabétologue, diabétomètre.
« passer à travers »; cf. lat. impérial diabetes « conduit, canal par où l'eau passe ». Fréq. abs. littér. :45. Bbg. EYRAUD (D.). Vive la lang. Vie Lang. 1969, p. 199.diabète [djabɛt] n. m.ÉTYM. XVe, dizabete; lat. médiéval diabetes, grec diabêtês « qui traverse », à cause de l'émission surabondante d'urine.❖♦ Médecine.1 État pathologique s'accompagnant d'une élimination excessive d'urine, avec soif intense. || Diabète insipide, en rapport avec une perturbation hormonale de l'hypophyse.2 Diabète sucré, (cour.) diabète : maladie liée à un trouble de l'assimilation des glucides, avec présence de sucre dans le sang (hyperglycémie) et dans les urines (glycosurie). || Avoir du diabète. ⇒ Diabétique (cit.). || Traitement du diabète par l'insuline.0 (…) une main enflée par le diabète, mais qui serre tout de suite sans tâtonner, dure, impérieuse.Bernanos, Journal d'un curé de campagne, I, p. 21.➪ tableau Principales maladies et affections.❖DÉR. Diabétique, diabétogène, diabétologue, diabétomètre.
Encyclopédie Universelle. 2012.
